Senescent effect of different concentrations of glucose on fibroblast
-
摘要:背景 衰老是生理或病理过程综合作用的必然结果。研究如何延缓衰老,尤其是病理性衰老,可为许多疾病的治疗提供新的思路。而建立老化细胞模型正是衰老相关研究的基石。目的 探究含不同浓度葡萄糖的DMEM培养液诱导皮肤成纤维细胞老化的效果,为衰老研究提供实验基础。方法 分别采用含5.5 mmol/L、15 mmol/L、25 mmol/L、35 mmol/L和45 mmol/L葡萄糖的DMEM培养基培养成纤维细胞,通过CCK-8实验和细胞划痕试验观察细胞增殖、迁移功能的变化;对细胞进行β-半乳糖苷酶染色,判断细胞是否发生衰老;采用PCR检测衰老相关p53/p21通路中关键效应分子p53、p21和p16在不同组中的表达水平。结果 相较于5.5 mmol/L组,15 mmol/L组和25 mmol/L组成纤维细胞增殖和迁移功能提高,而35 mmol/L组和45 mmol/L组细胞增殖和迁移能力显著下降;β-半乳糖苷酶染色阳性的细胞比例随葡萄糖浓度的升高而增加;同时,p53、p21和p16的表达与葡萄糖浓度呈正相关。结论 高浓度葡萄糖(≥35 mmol/L)可抑制细胞的生物学功能,诱导细胞衰老,其分子机制可能是通过上调p53/p21通路引起p16表达水平的增高。Abstract:Background Aging is the inevitable result of the comprehensive action of physiological or pathological processes. Research on how to delays aging, especially pathological aging, can provide new ideas for the treatment of many diseases. The establishment of aging cell model is the cornerstone of aging related research.Objective To explore the effect of Dulbecco's Modified Eagle Medium (DMEM) with different concentrations of glucose on skin fibroblast aging.Methods Fibroblasts were cultured in DMEM medium containing different concentrations of glucose (5.5 mmol/L, 15 mmol/L, 25 mmol/L, 35 mmol/L and 45 mmol/L). Cell proliferation and migration were detected by CCK-8 test and cell scratch assay, respectively. β-galactosidase staining was employed to determine the percentage of senescent cell. PCR was used to detect the expression levels of p53, p21 and p16 in each group to elucidate the underlying mechanism.Results Compared with the 5.5 mmol/L group, the proliferation and migration of fibroblasts in the 15 mmol/L and the 25 mmol/L groups increased, while significantly decreased in the 35 mmol/L and the 45 mmol/L groups; the proportion of SA-β-gal positive cells increased along with the glucose concentration. Meanwhile, the expressions of p53, p21 and p16 were also positively correlated with glucose concentrations.Conclusion Excessively high concentration of glucose (≥35 mmol/L) inhibits the biological function of cells and induces cell senescence. The pathogenesis is associated with increased expression of p16 via upregulation of p53/ p21 pathway.
-
Keywords:
- high glucose /
- cell senescence /
- fibroblast /
- beta-galactosidase /
- p53 gene
-
衰老是发生于生物有机体的一个普遍特征[1]。在多细胞生物中,衰老表现为分子水平、细胞水平和组织水平的功能逐渐丧失。衰老是一项不可逆转的自然进程,越来越多的研究证据表明一些不良因素可加速细胞、组织、甚至机体的衰老,如感染、缺氧、光老化等[2]。近年来,高糖引起的细胞衰老在各个器官得到了普遍的证实[3]。在慢性高糖环境的作用下,细胞内产生大量活性氧物质(reactive oxygen species,ROS),ROS可加速端粒缩短、引起DNA损伤反应(DNA damage response,DDR)并导致衰老相关的细胞生长停滞[4-6]。成纤维细胞在慢性糖基化过程中,其细胞骨架的Vimentin蛋白是糖基化终产物的作用靶点之一,长期刺激可导致细胞外基质的机械性能及其与细胞的相互作用均被改变,进而影响细胞的生物学功能[7-9]。本文旨在比较不同浓度和不同作用时间高糖DMEM培养液对成纤维细胞的老化作用,为高糖诱导成纤维细胞老化的体外模型建立提供一定的参考。
材料和方法
1 实验设备和试剂
CO2细胞培养箱,赛默飞公司;荧光显微镜,莱卡公司;Realtime qPCR,赛默飞公司;中性蛋白酶Ⅱ,北京索莱宝科技有限公司;DMEM低糖培养液,Gibco;DMEM高糖培养液,Gibco;200 g/L葡萄糖溶液,Gibco;Cell Counting Kit-8试剂盒,Dojindo东仁化学科技有限公司;β-半乳糖苷酶染色试剂盒,Sigma;TRIZOL,Invitrogen;FastKingcDNA第一链合成预混试剂,天根生化科技有限公司;SuperRealPreMix Plus (SYBR Green),天根生化科技有限公司。
2 原代成纤维细胞分离及培养
皮肤来源于一名20岁健康男性包皮环切术所切除的包皮组织。碘伏浸泡10 min后,用PBS漂洗3 ~ 5次,直至漂洗液清亮透明;去除脂肪组织和结缔组织后,将标本剪成1 mm3的组织块,置于含0.5%中性蛋白酶Ⅱ的磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,4℃消化过夜。收集可覆盖3.5 cm培养皿底部的真皮组织块,加入1 mL血清,然后将组织均匀地贴附于T25培养瓶下表面,垂直置于37℃细胞培养箱中1 h,之后将培养瓶翻转平放,缓慢加入少许DMEM培养液,以刚刚浸没组织块为宜。第2天再向瓶中加入少许培养液。之后每3 d换液1次,并在倒置显微镜下观察。约4 d后组织块周围可见少量梭形的细胞爬出,7 d后组织块周围可见大量呈编织状排列的细胞。PBS冲洗,消化,传代,用含10%血清的DMEM培养基传代培养至第5代(P5)。
3 细胞增殖能力的测定
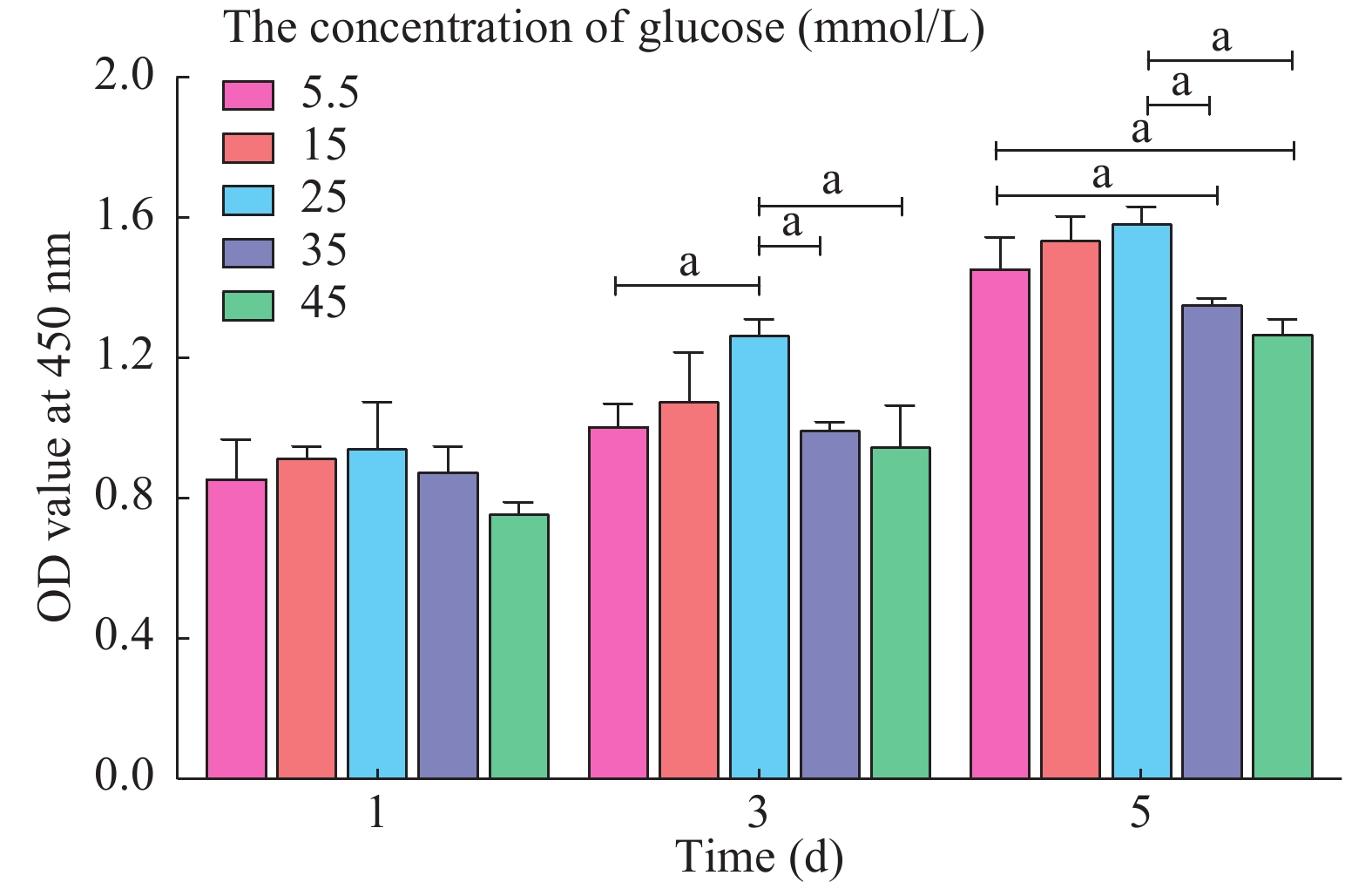
本实验采用CCK-8实验对细胞增殖能力进行评估。首先,将成纤维细胞接种于4个96孔板中,接种细胞密度约为2×103/孔,在培养箱中过夜,使细胞充分贴壁。次日,在96孔板中,根据分组情况,分别给予含5.5 mmol/L、15 mmol/L、25 mmol/L、35 mmol/L和45 mmol/L葡萄糖的DMEM培养基进行细胞培养,每组设3个复孔。并于1 d、3 d和5 d时,随机抽取一个96孔板进行光密度值(optical density,OD)测定。首先,弃去细胞培养液,将CCK-8溶液与DMEM培养基按1∶10的比例混匀后,每孔加入110 μL混合液,同时在无细胞的孔中加入等量PBS作为空白对照。37℃避光孵育2 h后用酶标仪(Biotek,VT,USA)分别测量每个孔在450 nm波长处的吸光度,即OD值。
4 细胞迁移能力的测定
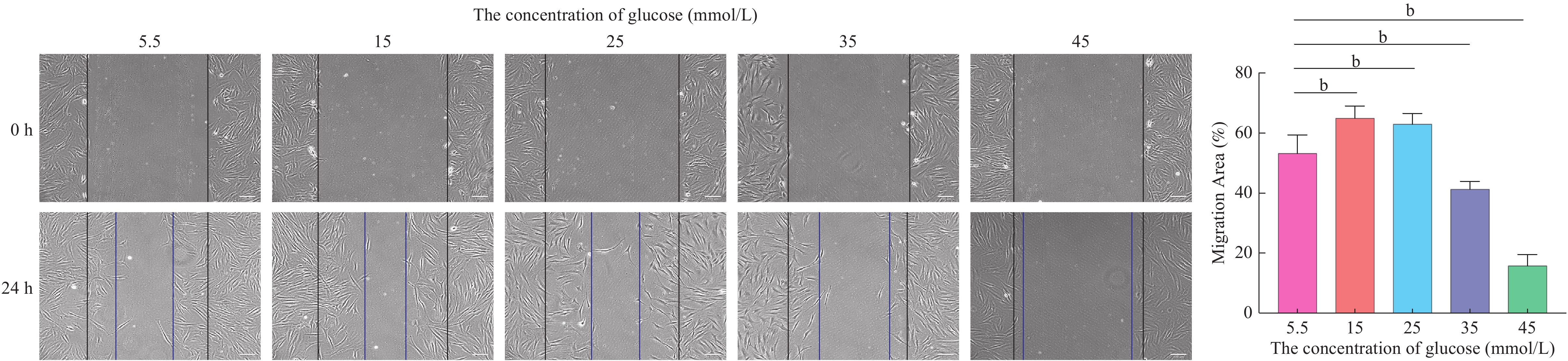
通过划痕实验检测成纤维细胞在不同培养条件下的迁移能力。首先,将成纤维细胞接种在6孔板中,培养12 h,待细胞完全贴壁后更换为分别含5.5 mmol/L、15 mmol/L、25 mmol/L、35 mmol/L和45 mmol/L葡萄糖的DMEM培养基。待细胞达到90% ~ 100%单层融合时,用200 μL移液枪头划一条直线,PBS洗涤3次后加入不含血清的培养基继续培养,并分别于0 h和24 h时拍摄照片,比较不同组间细胞的迁移情况,并通过细胞重新覆盖的面积评估细胞的迁移能力,其计算公式:(初始空白面积-实时空白面积)/初始空白面积×100%。
5 细胞衰老判定
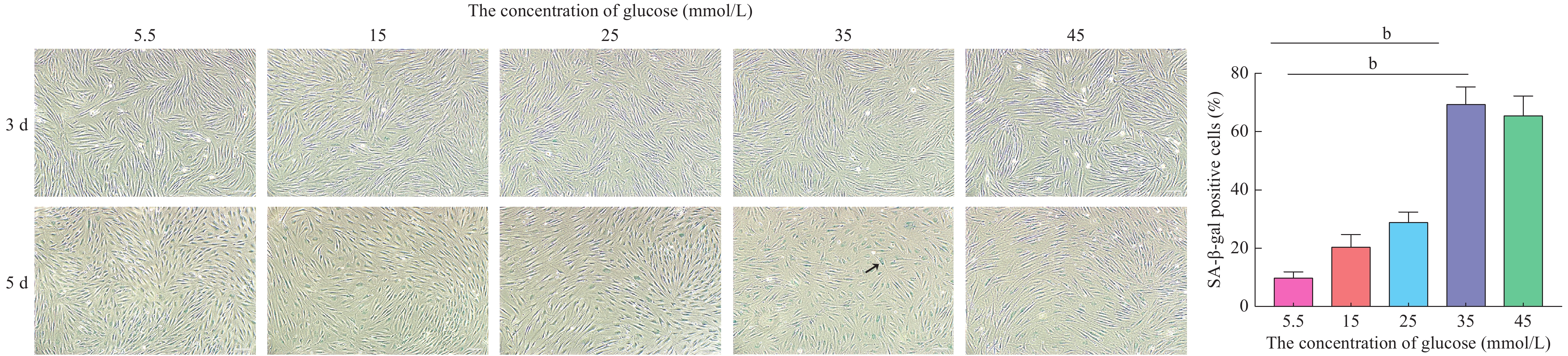
β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-Gal)活性水平上调是细胞衰老的重要特征之一。因此,我们采用细胞衰老β-半乳糖苷酶染色试剂盒(Sigma)检测各组细胞SA-β-gal的表达,从而判断细胞是否发生衰老。通过β-半乳糖苷酶染色,衰老细胞在显微镜下呈现出蓝色。首先,将细胞接种至6孔板中,分别用不同的培养基培养。第3天和第5天时观察SA-β-gal着色情况。吸除培养液,PBS洗涤1次,每孔加入1 mL固定液室温下固定10 min;配制SA-β-gal染色溶液,每孔加入1 mL,封包后37℃水浴过夜。次日于光学显微镜下观察。分别计数蓝色细胞和总细胞数,确定SA-β-gal阳性细胞的比例。
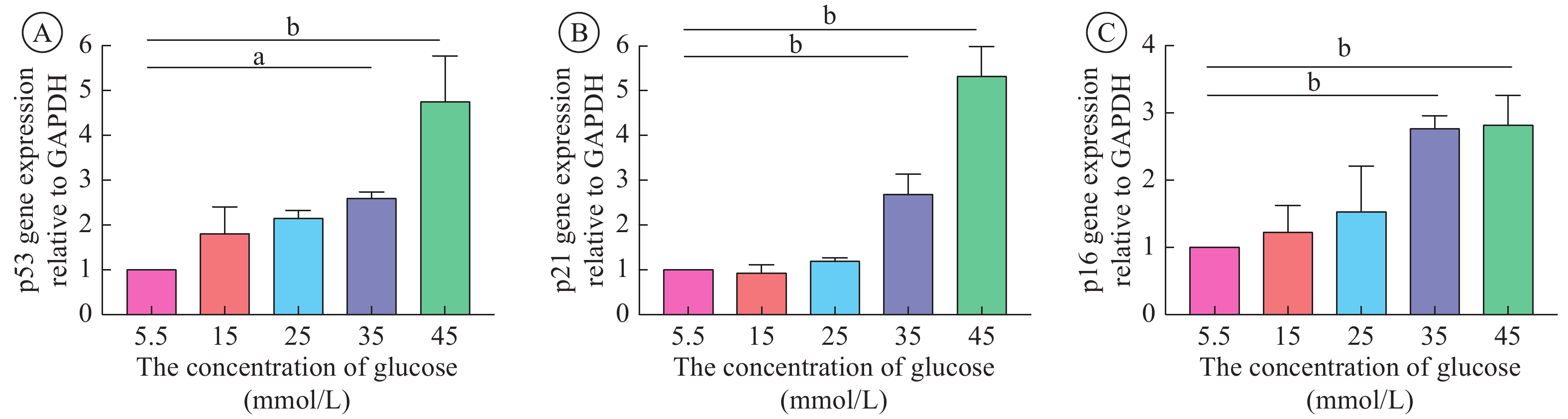
6 qRT-PCR检测细胞p16、p21和p53的基因表达
将细胞接种在6孔板中,并在特定的培养基中培养5 d;每孔依次加入1 mL Trizol(Invitrogen),200 μL氯仿,500 μL异丙醇,提取细胞中的RNA;75%乙醇洗涤纯化RNA后风干;加入DEPC水溶解沉淀后,用分光光度计测量各组RNA浓度;使用反转录试剂盒(FastKing gDNA Dispelling RTSuperMix)合成cDNA,再分别加入GAPDH、p53、p21和p16引物进行基因扩增。
7 统计学分析
数据采用SPSS Statistics(IBM,Armonk,NY)进行统计分析。计量资料以
$\bar x \pm s$ 表示。多组间比较采用单因素方差分析,两两比较采用Dunnett-t法及SNK法,P<0.05为差异有统计学意义。结 果
1 高糖环境导致成纤维细胞增殖能力下降
CCK-8实验发现,与5.5 mmol/L组相比,随着葡萄糖浓度的升高,成纤维细胞的增殖能力逐渐增高,并于25 mmol/L时达到顶峰;当给予更高浓度的葡萄糖环境(≥ 35 mmol/L)进行培养时,成纤维细胞的增殖能力逐渐下降。该结果说明适当的高糖环境(25 mmol/L)可促进成纤维细胞的增殖,而过高的葡萄糖浓度(≥ 35 mmol/L)则会对成纤维细胞的增殖产生抑制作用。第1天、第3天时,35 mmol/L和45 mmol/L组的OD值与5.5 mmol/L组比较无统计学差异;而第5天时35 mmol/L和45 mmol/L组OD值低于5.5 mmol/L组(P<0.05)(图1)。说明随着高糖环境作用时间的延长,成纤维细胞的增殖能力受损更加显著。
2 高糖环境损害成纤维细胞的迁移能力
划痕试验发现,当葡萄糖浓度为15 mmol/L和25 mmol/L时,成纤维细胞的迁移能力较5.5 mmol/L时提高;而当葡萄糖浓度 ≥ 35 mmol/L时,成纤维细胞的迁移能力明显下降(P<0.01)(图2)。
3 高糖环境使成纤维细胞SA-β-gal表达水平升高
当不同葡萄糖浓度的DMEM培养液作用第3天时,各组β-半乳糖苷酶染色阳性的成纤维细胞均较少,差异无统计学意义。而第5天时,采用35 mmol/L和45 mmol/L葡萄糖浓度DMEM培养液培养的成纤维细胞中β-半乳糖苷酶染色阳性的比例显著增加(P<0.01)(图3)。
4 高糖环境导致成纤维细胞p53、p21和p16表达上调
与5.5 mmol/L组相比,35 mmol/L组和45 mmol/L组成纤维细胞p53、p21和p16的表达均上调(P< 0.05)。说明当培养液中葡萄糖浓度 ≥ 35 mmol/L时,成纤维细胞出现衰老相关表型(p16表达上调)(图4)。由此推测,高糖诱导成纤维细胞老化的分子机制可能是通过上调p53/p21通路,进而引起p16表达水平的升高。
讨 论
细胞衰老是一种自然发生的、不可避免的过程[10]。然而,当细胞受到持续性促增殖信号刺激,或端粒和线粒体功能损害时[11-12],亦会出现衰老现象,这是细胞对损伤的反应。损伤为一过性时,细胞会出现短暂的细胞周期阻滞,伴p53及其下游信号分子p21表达上调。应激解除后细胞即可恢复增殖,而不会发生细胞衰老。当损伤持续存在时,p53/p21下游的CDKN2A位点激活,产生大量p16,进而导致不可逆的细胞生长停滞。在这一阶段,DNA发生持续性损伤,此时细胞出现特征性的衰老细胞相关表型[13],包括:1)衰老相关异染色质位点激活;2)DNA损伤;3)β半乳糖苷酶上调;4)p16表达上调;5)端粒缩短;6)细胞增殖能力下降。
在本研究中,我们发现当葡萄糖浓度 ≥ 35 mmol/L时,成纤维细胞的增殖和迁移能力显著下降。β-半乳糖苷酶在3 d时差异不显著,而5 d时可见显著组间差异,说明该指标特异性强,可作为监测细胞是否发生衰老的特征性指标。Chen等[14]报道,4 d以上的持续性刺激方可导致细胞分裂进程停滞及不可逆性衰老进程的发生[15]。PCR结果表明,在高糖环境的作用下,成纤维细胞p53、p21和p16的表达上调,说明p53/p21通路可能是高糖环境导致细胞老化的作用靶点。总之,适当的葡萄糖浓度(25 mmol/L)可提高成纤维细胞的增殖和迁移功能,而过高浓度(≥35 mmol/L)会抑制成纤维细胞的生物学功能,诱导细胞发生老化,且该作用呈时间和浓度依赖性。本研究为高糖诱导成纤维细胞衰老体外模型的建立提供了一定的理论依据,该模型可用于拮抗高糖引发的细胞衰老的药物研究体外实验,或高糖引发细胞衰老机制的进一步探索。
-
-
[1] Tabibzadeh S. Cell-centric hypotheses of aging[J]. Front Biosci (Landmark Ed),2021,26: 1-49.
[2] Kaur J,Farr JN. Cellular senescence in age-related disorders[J]. Transl Res,2020,226: 96-104. doi: 10.1016/j.trsl.2020.06.007
[3] Bian X,Li B,Yang J,et al. Regenerative and protective effects of dMSC-sEVs on high-glucose-induced senescent fibroblasts by suppressing RAGE pathway and activating Smad pathway[J]. Stem Cell Res Ther,2020,11(1): 166. doi: 10.1186/s13287-020-01681-z
[4] Harper ME,Bevilacqua L,Hagopian K,et al. Ageing,oxidative stress,and mitochondrial uncoupling[J]. Acta Physiol Scand,2004,182(4): 321-331. doi: 10.1111/j.1365-201X.2004.01370.x
[5] Buranasin P,Mizutani K,Iwasaki K,et al. High glucose-induced oxidative stress impairs proliferation and migration of human gingival fibroblasts[J]. PLoS One,2018,13(8): e0201855. doi: 10.1371/journal.pone.0201855
[6] Cadau S,Leoty-Okombi S,Pain S,et al. In vitro glycation of an endothelialized and innervated tissue-engineered skin to screen anti-AGE molecules[J]. Biomaterials,2015,51: 216-225. doi: 10.1016/j.biomaterials.2015.01.066
[7] Kueper T,Grune T,Muhr GM,et al. Modification of vimentin:a general mechanism of nonenzymatic glycation in human skin[J]. Ann N Y Acad Sci,2008,1126: 328-332. doi: 10.1196/annals.1433.039
[8] Kueper T,Grune T,Prahl S,et al. Vimentin is the specific target in skin glycation. Structural prerequisites,functional consequences,and role in skin aging[J]. J Biol Chem,2007,282(32): 23427-23436. doi: 10.1074/jbc.M701586200
[9] Bainbridge P. Wound healing and the role of fibroblasts[J]. J Wound Care,2013,22(8): 407-408,410-412. doi: 10.12968/jowc.2013.22.8.407
[10] Sharpless NE,Sherr CJ. Forging a signature of in vivo senescence[J]. Nat Rev Cancer,2015,15(7): 397-408. doi: 10.1038/nrc3960
[11] Demidenko ZN,Blagosklonny MV. Growth stimulation leads to cellular senescence when the cell cycle is blocked[J]. Cell Cycle,2008,7(21): 3355-3361. doi: 10.4161/cc.7.21.6919
[12] Childs BG,Durik M,Baker DJ,et al. Cellular senescence in aging and age-related disease:from mechanisms to therapy[J]. Nat Med,2015,21(12): 1424-1435. doi: 10.1038/nm.4000
[13] He S,Sharpless NE. Senescence in Health and Disease[J]. Cell,2017,169(6): 1000-1011. doi: 10.1016/j.cell.2017.05.015
[14] Chen X,Zhang W,Gao YF,et al. Senescence-like changes induced by expression of p21(waf1/Cip1) in NIH3T3 cell line[J]. Cell Res,2002,12(3-4): 229-233. doi: 10.1038/sj.cr.7290129
[15] Dai CY,Enders GH. p16 INK4a can initiate an autonomous senescence program[J]. Oncogene,2000,19(13): 1613-1622. doi: 10.1038/sj.onc.1203438





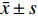
 下载:
下载: